Trióxido de Arsénico
|
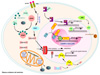
Caspasas y apoptosis Las células dañadas son eliminadas del cuerpo por dos mecanismos: necrosis y apoptosis. En el caso de la necrosis, se presenta una disfunción de todos los orgánulos celulares, produciéndose, en último término, la lisis celular con liberación de los factores que causan la inflamación. En las células que entran en apoptopsis se observa un estrechamiento del citosol con pérdida de contacto de las células vecinas por alteraciones de las moléculas de adhesión de la membrana. En el citoplasma se forman unas vesículas, llamadas cuerpos nucleares o cuerpos apoptóticos que contienen restos del núcleo protegidos por la membrana nuclear. Estos cuerpos apoptóticos son fagocitados de inmediato por las células adyacentes o por fagocitos profesionales. Además, en estos cuerpos se producen toda una serie de cambios estructurales provocados por la transmisión de señales de una serie de proteínas, las caspasas. La apoptosis se presenta en células sometidas a estrés por radiaciones ionizantes, compuestos mutagénicos, en la embriogenesis, en la metamorfosis, en las células que son recambiadas, etc., por activación de unos receptores de muerte. A través de una serie de moléculas más o menos específicas según los tejidos, se desencadena una serie de señales que, en ultimo término dirigen las células al suicidio. La apoptosis está regulada por las caspasas, unas cisteín-proteasas que juegan un papel fundamental en la maduración de citokinas y en la condensación y fragmentación nuclear. Se conocen al menos 10 tipos de caspasas que se clasifican en tres grupos según la función que desempeña: las caspasas del grupo A actúan sobre todo en maduración de las citokinas, las del grupo B son las primeras activadas en la apoptosis inducida por diferentes estímulos y se denomina iniciadoras y las del grupo C, activadas por las anteriores, se encargan de romper toda una serie de sustratos durante la apoptosis (caspasas efectoras). Existen dos cascadas principales implicadas en la apoptosis. La primera de ellas se inicia en la membrana celular al llegar a los receptores CD95 y TNFr sus correspondientes ligandos, la CD-95L y el FNTa.. Estos dos receptores forman parte de un complejo llamado DISC (por sus iniciales en inglés de complejo de iniciación de la señalización de muerte). Este complejo genera una señal que recluta las caspasas iniciadoras, en particular la caspasa 8. La segunda
cascada involucra la mitocondria en la que se produce en determinadas
ocasiones una apertura de los megoporos mitocondriales llamados PT
(poros de transición) por los que el citocromo c pasa al citoplasma.
Allí, junto con la Hsp90, activa el APAF (factor 1 de activación
de proteasas), el cual, a su vez activa la caspasa 9. El resultado
final es la activación de la caspasa 3 por la caspasa 8 y la
caspasa 9. Ambas caspasas ocasionan la degradación de la poli-(ADP-ribosa)-polimerasa
(PDPR) impidiendo la reparación del ADN y provocando la apoptosis. |
|
Efectos sobre los genes que controlan la apoptosis Es bien conocido el papel de la proteína supresora de tumores p53 en diversos tipos de cáncer. La p53 induce la parada del ciclo celular en G1 en las células normales cuando se detecta un daño del DNA. Si el DNA no puede ser reparado, la acumulación de p53 produce la apoptosis de la célula. Esto ocurre sólo en las células normales, cuando la proteína p53 funciona correctamente. Cuando esta proteína es defectuosa (por mutación del gen TR53 que la codifica), no hay parada en G1 ni apoptosis. Recientemente se ha descubierto una interdependencia entre la p53 y la PLM. Si esta última no está intacta, la apoptosis inducida por la p53 no tiene lugar. Por lo tanto, la degradación de la PLM inducida por el arsénico decrecerá la actividad de la p53 en las células normales, protegiendo las células leucémicas de la apoptosis. ¿Como explicar entonces que el arsénico induce la apoptosis en las células con defectos genéticos? Se conocen varios mecanismos por los cuales el arsénico induce vías proapotósicas: por ejemplo, el arsénico induce la acumulación de la Daxx, una proteína que reprime la transcripción y que se localiza en los cuerpos nucleares. A su vez, la Daxx modula varios factores que regulan la apoptosis, de manera que su acumulación producida por el arsénico puede desencadenar la producción de varios genes apoptósicos. Otra proteína que se acumula en presencia de arsénico es la SUMO-1, una proteína también implicada en la señal proapotósica. Esta proteína, con propiedades similares a la ubiquitina se une a la p53, PLM y Daxx (y otras muchas proteínas) para ejercer sus efectos sobre la apoptosis. La exposición al arsénico de las células APL (y de otros muchos tipos de leucemias) afecta a la regulación del gen Bcl-2 y a las proteínas que expresa que actúan como supresoras/inductoras de la apoptosis y a las proteínas Bax, que son pro-apoptósicas. Las que muestran actividad pro-apoptósica aumentan la permeabilidad de la membrana mitocondrial permitiendo que pasen al citoplasma el citocromo c. Las que tienen actividad anti-apoptósica se oponen a las primeras. El resultado final es que el trióxido de arsénico estimula las células hacia la apotopsis. |
||
|
|
||