| PRODUCCION
DE INSULINA RECOMBINANTE
Simultáneamente
a los avances obtenidos en la dilucidación de la estructura 3D
de la insulina y de su biosíntesis en los mamíferos, los
biólogos moleculares aislaban los genes responsables de la producción
del proinsulina (Villa-Komaroff, L. y col., 1978) y pronto la industria
farmaceútica vislumbró la posibilidad de obtener insulina
humana por clonación de genes en bacterias.
La insulina
humana ha sido el primer producto comercial de la clonación de
genes y su éxito ha sido debido al pequeño tamaño
de la molécula que hizo posible la síntesis química
de un gen.
La estrategia
seguida para la producción de insulina humana recombinante fué
la siguiente: En primer lugar, se sintetizaron químicamente las
cadenas de ADN con las secuencias correspondientes a las cadenas de
glicocola y fenilalanina, siendo necesarias 63 nucleótidos para
la primera y 90 para la segunda más un triplete para señalar
el fin de la traducción. Además. Para facilitar la separación
de los productos sintetizados, se añadió a cada gen el
triplete correspondiente a la metionina.
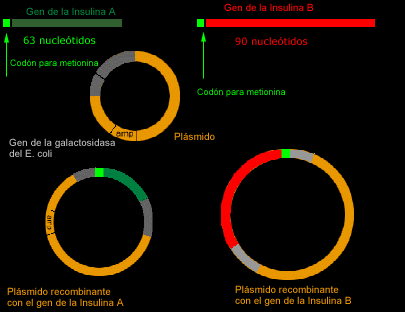
Los genes
sintéticos A y B se insertaron por separado en el gen bacteriano
responsable de la b-galactosidasa y presente en un plásmido.
Los plásmidos recombinantes se introdujeron en E. coli donde
se multiplicaron, fabricando un ARNm que tradujo una proteína
quimérica, en la que una parte de la secuencia de la b-galactosidasa
estaba unida por una metionina a la cadenas de glicocola o de fenilalanima
de la insulina. Como ninguna de las cadenas de insulina contiene metionina,
esto se aprovecho para separar las cadenas de la insulina del resto
de proteína quimérica rompiendola con bromuro de cianógeno
que destruye la metionina. Después de purificadas, las cadenas
de unieron mediante una reacción que forma puentes disulfuro,
|


