PRODUCTOS DE GLICACION AVANZADA
 |
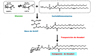
La glucosa, una de las fuentes primarias de energía en los animales, es una molécula muy reactiva, al poseer un grupo aldehido libre. En presencia de grupos amino (como los presentes en las proteínas), la glucosa reacciona para originar las bases de Schiff de acuerdo con el siguiente esquema: C5O5H11-CH=O
+ RNH2 Glucosa
+ grupo amino Las bases de Schiff son poco estables y experimentan espontáneamente la llamada transposición de Amadori para formar los llamados compuestos de Amadori, a su vez precursores de los productos de glicación avanzada (Advanced Glycation End Products, AGEs). Al no intervenir ninguna enzima en esta reacción, estos compuestos también reciben el nombre de productos de glicación no enzimática. Aunque la reacción anterior es la más importante para la generación de AGEs, también pueden formarse por autooxidación de la glucosa y por glicólisis de la glucosa para producir metilglioxal, otro precursor de los AGEs. Los AGEs constituyen un grupo complejo y heterogéneo de compuestos formados por la reacción no enzimática de los azúcares reductores como la glucosa con aminoácidos, péptidos, proteínas y ácidos nucleicos. En particular algunos intermedios reactivos como el metilgloxal modifican rápidamente las cadenas laterales de las proteínas, sobre todo a las que llevan arginina o lisina con grupos amino libres. Todas las proteínas pueden experimentar reacciones de glicación no enzimática, experimentando una alteración de su función. Por ejemplo, la hemoglobina glicosilada, HbA1C, tiene una menor afinidad por el oxígeno; cuando la albúmina se glica se reduce su afinidad por la bilirrubina en un 50% y en un 95% por los ácidos grasos. La glicación de la LDL conduce a una menor captación por los fibroblastos y por tanto a un menor aclaramiento plasmático. La glicación de la fibrina, reduce su degradación por la plasmina. En el caso de la antitrombina III, su glicación disminuye su afinidad por la heparina, con lo cual se reduce su capacidad para inhibir a la trombina. Una gran parte de la investigación sobre la glicación no enzimática "in vivo", se ha centrado en proteínas con un recambio metabólico muy lento, tales como las proteínas del cristalino, la mielina de los nervios y el colágeno de la matriz extracelular. Todas estas proteínas pertenecen a tejidos insulinoindependientes, se glican in vivo, y acumulan productos de Amadori a un ritmo acelerado en la diabetes. Los tejidos que las contienen, (cristalino, nervios y pared vascular), son los que se afectan más en procesos como la diabetes y el envejecimiento. Adicionalmente, la glucosa tiene la capacidad para reaccionar con los aminofosfolípidos (fosfatidilcolina, fosfatidiletanolamina, esfingomielina y fosfatidilserina), según muestra la figura, para formar bases de Schiff y compuestos de Amadori lipídicos que se comportan como potentes inductores de la formación de los lipoperóxidos que producen el estrés oxidativo. Por este motivo, los productos finales de la glicación de los lípídos denominados ALEs (Advanced lipoperoxidation end products).
|
|
|
Aunque hace más de 100 años que Maillard describió la via no enzimática de la glicación de las proteínas, sugiriendo que estas proteínas modificadas podrían desempeñar un papel en la patogenesis de algunas enfermedades crónicas, solo en los últimos 5 años este concepto está recibiendo una atención más amplia. Además, el interés por estos productos ha aumentado con el reconocimiento del papel que juega la hemoglobina glicosilada en la diabetes y en varias enfermedades asociadas a la vejez. Igualmente, la pentosidina un compuesto consistente en un puente molecular entre un residuo de lisina y otro de arginina, que se combinan en forma de un anillo que se forma por reacción de los dos aminoácidos con pentosas y con la glucosa, es un conocido marcador de las reacciones de glicación no enzimática, aunque se desconoce su mecanismo de formación. El descubrimiento de receptores específicos para estos productos de glicación avanzada, los RAGE, no ha hecho sino incrementar el interés por estos productos, ya que los RAGE intervienen en la génesis de algunas enfermedades crónicas y en particular en el desarrollo y mantenimiento del síndrome metabólico.
|
|
Los RAGE son unos receptores de membrana que pertenecen a la familia de las inmunoglobulinas, que convierten la activación celular a largo plazo en una enfermedad o disfunción crónica. Los RAGE parecen funcionar induciendo la transcripción del factor NF-KB proinflamatorio y suprimiendo los mecanismos endógenos de autoregulación, favoreciendo la perpetuación de la inflamación. La reducción de la acumulación de los AGEs en los tejidos, disminuye la activación de los receptores RAGE y reduce o elimina la inflamación exagerada. Se han identificado bastantes AGEs en los tejidos, siendo el más conocido la hemoglobina glicosilada, y lo que tienen en común todas ellos es que sus niveles están significativamente aumentados en los pacientes con enfermedades crónicas en comparación con los individuos sanos. Cuando estos AGEs se acumulan en los tejidos inducen una exacerbación de la inflamación o infección y debilitan el sistema inmunitario, alteran los mecanismos de reparación del ADN y, lo que es más importante, producen unas 50 veces más radicales libres que las correspondientes proteínas no glicosiladas.
|
||
Implicación de los AGEs en la patogénesis de las complicaciones diabéticas Los efectos provocados por los productos de glicación avanzada (AGEs) pueden ser clasificados como dependientes o independientes del receptor para AGEs un tipo de receptor situados en la superficie de determinadas células. Los componentes estructurales de la matriz del tejido conectivo y en particular los componentes de las membranas basales como el colágeno tipo IV, son dianas preferentes para la glicación, pero otras proteínas de vida media larga también pueden ser objeto de glicación avanzada, incluyendo la mielina, tubulina, el activador del plasminógeno 1 (PAI-1) y el fibrinógeno. La formación de entrecruzamientos intra- e inter-moleculares con el colágeno como resultado del proceso de glicación conduce a alteraciones estructurales que conllevan una pérdida de la elasticidad y aumento de la resistencia a la digestión proteolítica. Por ejemplo, el entrecruzamiento del colágeno tipo I y la elastina conduce a una mayor rigidez de los vasos sanguíneos. Los efectos provocados por los AGEs por la vía dependiente del receptor se desencadenan por la interacción de los AGEs con distintos receptores capaces de unir esas estructuras químicas características de los AGEs. El receptor más ampliamente estudiado es el denominado receptor para AGEs (RAGE),pero también han sido identificados otros receptores. El RAGE pertenece la superfamilia de las inmunoglobulinas y la interacción del AGE con el RAGE desencadena la activación de segundos mensajeros tales como la proteína kinasa C y la translocación del NF-kB al núcleo, donde incrementa la trascripción de proteínas incluyendo ICAM-1, Eselectina, endotelina-1, factor tisular, VEGF y citoquinas proinflamatorias. En consecuencia, tienen lugar una serie de procesos que ocurren tanto en el envejecimiento fisiológico de individuos normales como en pacientes diabéticos. Sin embargo, en estos últimos, y debido al estrés metabólico, los procesos conducentes al envejecimiento se verán notablemente acelerados Algunas de las patologías en las que intervienen de forma significativa los productos de glicación avanzada son: Neuropatía
periférica: La neuropatía periférica de la diabetes
y la senilidad, se asocia con desmielinización segmentaria, degeneración
axónica y una excesiva glicación de la mielina de los
nervios periféricos. En la neuropatía diabética
se ha visto que la glicación de la tubulina inhibe su polimerización,
siendo este mecanismo el responsable de las anomalías del transporte
axonal de las Cataratas: en el cristalino de los pacientes diabéticos, la glicación origina entrecruzamiento de proteínas y por tanto, formación de agregados; por otra parte, éstas se hacen más susceptibles a la oxidación debido a la alteración de su estructura. Todo ello facilita la aparición de cataratas Envejecimiento: diferentes datos sugieren que la reacción de Maillard podría jugar un papel importante en los procesos fundamentales del envejecimiento. Así, los signos mas marcados del envejecimiento se observan en tejidos que contienen proteínas de vida media larga como el colágeno y la elastina; de esta forma, las arterias, las articulaciones y la piel pierden al envejecer su elasticidad
|
||
REFERENCIAS
|
||
| Monografía creada el 17 de Octubre de 2010. Equipo de redacción de IQB | ||
| |