|
TROMBINA
|
||
|
|
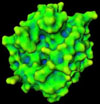
La trombina no es un constituyente normal de la sangre circulante, sino que se genera a partir de la protrombina o factor II mediante una reacción catalizada por el factor activado de Stuart (factor Xa). Es el paso final de las dos cascadas convergentes de reacciones, llamadas vía intrínseca y vía extrínseca de la coagulación. La ruptura de la protrombina entre los aminoácidos Arg274-Thr275 y Arg323-Ile324 produce la trombina de un peso molécular de 32 kd La trombina es una glicoproteína formada por dos cadenas de polipéptidos de 36 (*) y 259 (*) aminoácidos unidas por un puente disulfuro. Una vez activada, la molécula tiene una forma más o menos esférica (*) , en la que se han identificado tres puntos importantes:
El sitio activo de la trombina se parece a una estrecha hendidura con dos extremos "norte" y "sur". El núcleo del sitio activo está formado por residuos polares, mientras que ambos extremos de la hendidura son compuestos hidrofóbicos La trombina juega dos importantes papeles en la coagulación de la sangre (*)
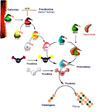
El mecanismo catalítico de la trombina (y de otras serinproteasas) se verifica en tres pasos: unión de la enzima al sustrato para formar un intermedio al tiempo que llega un ligando que interacciona con el intermedio y se desprende inmediatamente, formación de un aducto intermedio y desprendimiento del producto final y de la enzima libre Es interesante destacar que la activación de la función catalítica se verifica cuando se unen ligandos a los exositios 1 o 2. Por ejemplo, la hirudina, el factor II de la heparina o el receptor de trombina se unen al exositio 1 mientras que la trombomodulina, los glicosoaminoglicanos y otras moléculas lo hacen al exositio 2. La unión de cualquier ligando a uno u otro de los exositios produce cambios conformacionales de tal naturaleza que hacen imposible la unión a ambos, de modo que si un ligando se une a un exositio, desplaza al ligando unido al otro. Este mecanismo es importante ya que permite a la trombina una regulación de los mecanismos de coagulación/anticoagulación De esta manera, la hirudina (un anticoagulante de la saliva de las sanguijuelas) formada por un péptido de 65 aminoácidos se une de forma casi irreversible al exositio 1 de la trombina (y a áreas próximas al mismo) mediante tres enlaces disulfuro, formando un complejo no covalente e inactivando la trombina. De igual forma, cuando la trombomodulina se fija al exositio 2, cambia la conformación de la trombina que actúa entonces como factor activante de la proteína C pero sin poder ya degradar el fibrinógeno a fibrina. La proteína C es anticoagulante ya que inactiva los factores Va y VIIIa, los cuales inhiben a su vez la formación de trombina. Es realmente notable el hecho de que al unirse la trombomodulina a la trombina, la afinidad de esta hacia la proteína C aumente 1000 veces Además, la trombina tiene otras importantes funciones:
El mecanismo por el cual la trombina activa las plaquetas y otras células ha sido desconocido hasta hace poco. El clonado del receptor plaquetario a la trombina ha revelado el mecanismo de su activación. Una vez unida a su receptor, la trombina rompe la extensión aminoterminal del mismo para exponer una nueva secuencia de aminoácidos que se une a la tercera asa extracelular del receptor, activandolo. Esta secuencia capaz de autoactivarse ha sido llamada secuencia de amarre. Se han sintetizado varios péptidos con secuencias parecidas a la secuencia de amarre y se ha demostrado su capacidad para activar el receptor de trombina. Además, este mecanismo de activación ha sido demostrado en células no plaquetarias.
|
|
Monografía revisada el 15 de Octubre de 2010. Equipo de Redacción de IQB |
||
|
|