|
|
|
HIPERTERMIA O PIREXIA MALIGNA [ICD-10: T88.3]
|
|
La hipertermia maligna fue identificada como tal en 1960 por Denborough y Lovell en un paciente que falleció después de una anestesia general, sujeto con antecedentes familiares para esta predisposición. Hasta la introducción del dantroleno en 1980, la hipertermia maligna ocasionaba una mortalidad del 70-80%. Se trata de una enfermedad farmacogenética desencadenada por la administración de anestésicos generales volátiles (enflurano, isoflurano, halotano, etc) o fármacos despolarizantes tipo suxametonio. Cuando acontece, tiene lugar un hipermetabolismo desencadenado por la alteración aguda del equilibrio del calcio en el retículo sarcoplásmico de la célula muscular. La hipertermia maligna es una enfermedad heterogenética. Muchas familias con predisposición a la hipertermia maligna muestran una mutación en el cromosoma 19 donde se localizada el gen que codifica el receptor para rianodina (La rianodina es un alcaloide con propiedades insecticidas que permitió caracterizar unos canales intracelulares para el calcio situados en el retículo sarcoplásmico, que llevan el nombre de receptores para rianodina). Sin embargo, otras familias con predisposición a la hipertermia maligna no muestran ningún defecto de dicho receptor. Se conocen otros genes que están implicados en la hipertermia maligna. La hipertermia maligna debida a mutaciones en el receptor de rianodina se denomina Hipertermia Maligna 1 (MHS1). Otras variantes de la hipertermia son:
La incidencia
de hipertermia maligna oscila entre 1:10.000 y 1:50.000 actos anestésicos.
La incidencia media en niños es algo más alta (1:15.000).
La mayor incidencia de casos es observada en jóvenes varones.
Se ha encontrado también que la frecuencia más alta tiene
lugar durante la cirugía de malformaciones músculoesqueléticas
como el estrabismo, la hernia, la escoliosis, cirugía plástica,
criptorquídia y cirugía dental. Las formas más
graves se han descrito en casos de cirugía traumatológica
de urgencia |
||
|
|
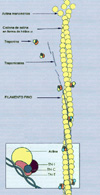
El calcio juega un importante papel en la contracción muscular. Cuando se estimula neuronalmente la fibra muscular, el calcio se libera del retículo sarcoplásmico. Este retículo es un sistema de túbulos situados a lo largo de las fibras musculares esqueléticas que inician y controlan el proceso de la contracción. Cuando el potencial de acción atraviesa las membranas de las fibras musculares, el retículo sarcoplásmico transmite el potencial de acción al interior de la fibra muscular (*) La fibra muscular se compone de miofibrillas que a su vez poseen filamentos gruesos (miosina) y filamentos delgados (actina). Además dos moléculas de proteínas (troponina y tropomiosina) se disponen a lo largo de la banda de actina. La troponina a su vez se compone de tres subunidades: TnT,TnI, y TnC. La TnT se une fuertemente a la tropomiosina que cubre los lugares en que la actina se une a la miosina. La subunidad TnI se une a la actina y la TnC se une al calcio. El complejo troponina-tropomiosina reprime la interacción de la miosina con la actina y por ello mantiene el músculo en estado de reposo. Al liberarse los iones de calcio del retículo sarcoplásmico al citoplasma circundante, estos iones difunden hacia las fibras musculares, uniéndose a un filamento. En las paredes del retículo sarcoplásmico se localiza una bomba de calcio continuamente activa. Bajo dicha bomba existe un canal de liberación del calcio que se conoce como receptor de rianodina. La bomba extrae el calcio del sarcoplasma de vuelta a las cavidades del retículo sarcoplásmico. La relajación muscular normal ocurre cuando los iones de calcio son removidos desde el sarcoplasma hacia el retículo. Una mutación en el receptor de rianodina puede, por tanto, alterar su funcionalidad, con lo que la relajación muscular no tiene lugar. Las concentraciones elevadas de calcio producen una estimulación de todos los procesos calcio-dependientes del músculo esquelético, ocasionando la acidosis metabólica. El hipermetabolismo produce, además, varios signos clínicos como hipertonía, arritmias, taquicardia e hipertermia. Los signos de laboratorio son hiperkaliemia, elevación de la creatina kinasa y mioglobinuria debidos todos ellos a lesiones de las membranas plasmáticas de las células musculares. Los
anestésicos volátiles y los fármacos despolarizantes
como el suxametonio ocasionan un aumento de la concentración
de calcio mioplasmático. Este aumento de calcio induce la activación
de los filamentos de actina y de miosina y explica la rigidez muscular
en el espasmo del masetero que es uno de los primeros signos de la hiperpirexia
maligna. |
|
|
SINTOMAS CLÍNICOS La primera manifestación de una hipertermia maligna suele ser el espasmo maseterino. Seguidamente aparecen una acidosis metabólica, aumento de la creatina kinasa, hipercapnia, arritmias y taquicardia. En este estadio, el diagnóstico diferencial incluyen la tirotoxicosis, el feocromocitoma, la porfiria, la hipovolemia y la hipoxia. Finalmente aparecen arritmias complejas, hipertermia y cianosis. Uno de los síntoma típicos de la hipertermia maligna es la rigidez muscular, que aparece en el 75% de los casos, y es consecuencia de la contracción muscular mantenida, a pesar del uso de relajantes musculares no despolarizantes. El inicio de la hipertermia es variable, siendo a veces tardío. Se pueden alcanzar temperaturas de hasta 40-43º. Como signos de esta hiperpirexia aparece la sudoración para iniciar la pérdida de calor, así como un exantema a nivel de cráneo, cuello y tórax superior. Ocasionalmente puede desarrollarse una insuficiencia renal que cuando aparece se debe fundamentalmente a la hipoperfusión renal y a la lesión tubular que produce la hipermioglobinuria. DIAGÓSTICO El diagnóstico se ha de hacer no sólo sobre el paciente susceptible, sino también sobre los familiares. Aunque se han propuesto varias pruebas, la más fiable es el test de contracción con halotano/cafeína que se lleva a cabo con una pequeña porción de músculo estriado. Para llevar a cabo esta prueba, se toman 2 g de tejido muscular, usualmente mediante una incisión del muslo después de la administración de un anestésico local o epidural que no induzca la hipertermia maligna. Después, se registran electrónicamente la velocidad y la fuerza con la que contraen las fibras musculares en presencia de cafeína sola o con halotano. Los músculos de los sujetos con predisposición a la hipertermia maligna son más sensibles y se contraen con más fuerza que los músculos normales. Como alternativa se ha propuesto el test de la contracción muscular inducida por rianodina, pero la prueba también requiere una biopsia y es tan laboriosa y costosa como el de la contracción por halotano/cafeína La determinación de la creatina-kinasa plasmática es útil para el cribado de familias con predisposición a la hipertermia maligna pero no es aplicable a la población en general. TRATAMIENTO El tratamiento de una crisis de hipertermia maligna consiste en una serie de medidas encaminadas a discontinuar el proceder anestésico, combatir la hipoxemia y la acidosis, controlar la temperatura corporal y contrarrestar las posibles complicaciones. Por lo tanto, si se sospecha una hipertermia maligna es necesario:
|
||
|
REFERENCIAS
|
||
Monografía revisada el 5 de Octubre de 2010. Equipo de redacción de IQB
|
||
|
|