
|
ENFERMEDAD DE ALZHEIMER |
 |
En 1963, se descubría que los ovillos de neurofibrillas eran estructuras filamentosas acumuladas en el citoplasma de las neuronas degeneradas, filamentos que fueron denominados "parejas de filamentos helicoidales" o PHFs. Estos filamentos están formados por microtúbulos citoesqueléticos asociados a las llamadas proteínas tau, que pertenecen a la famila de la "Proteínas asociadas a los microtúbulos" o MAP.
|
|
|
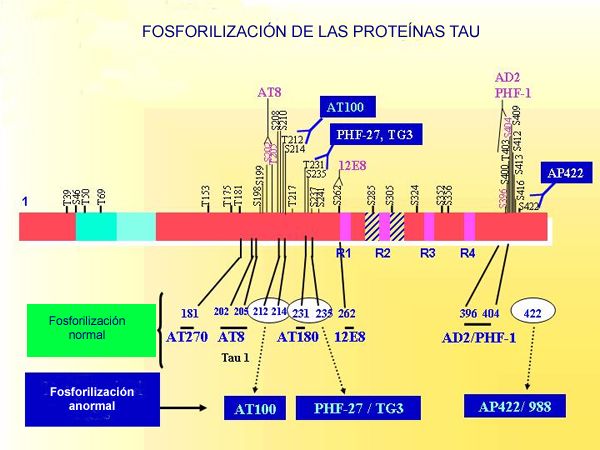
En
el cerebro humano, las proteínas tau se presentan como seis isoformas
de 352 a 441 residuos de aminácidos que provienen todas ellas de la
expresión de un único gen tau localizado en el brazo largo del cromosoma
17. Se conocen perfectamente todas las propiedades físico-químicas de
esta proteínas y como interaccionan con los microtúbulos neuronales
estabílizándolos. Las proteínas tau se caracterizan por fosforilizarse
fácilmente, permitiendo esta reacción la movilidad de las mismas dentro
de los axones de las neuronas en direccción centrífuga. En la enfermedad
de Alzheimer y otras tauopatías se produce un fenómeno de hiperfosforilización
y/o de fosforilización anormal que en definitiva, es el responsable
de la formación de los complejos proteínas tau-PHFs. En la actualidad,
los esfuerzos de los investigadores se encaminan a la idenficación de
las proteína-quinasas implicadas en esta fosforilización anormal. El
conocimiento de un estructura permitiría eventualmente, el diseño de
un inhibidor enzimático que frenase o eliminase las proteínas tau anormales
y por lo tanto la formación de ovillos de neurofibrillas
|
||
|
|
||

