ESTRUCTURA DE LA INMUNOGLOBULINA IgG |
||
|
|
||
|
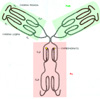
La inmunoglobulina gamma (designada como IgG) es el anticuerpo predominante en la sangre de la mayoría de los vertebrados superiores, y ha sido, de los cinco tipos (*) de inmunoglobulinas, la que más se ha estudiado. Tiene un peso molecular aproximado de 160.000, lo cual indica que su molécula consta de unos 23.000 átomos. A principios de la década de los 60, dos grupos de investigadores, dirigido uno por Rodney R. Porter, en Inglaterra, y otro por Gerald M. Edelman, en la Rockefeller University, demostraron que la IgG está formada por cuatro cadenas polipeptídicas, cada una de las cuales está formada por unidades de aminoácidos enlazados por enlaces peptídicos (*) . Las cuatro cadenas están apareadas, de modo que la molécula consta de dos mitades idénticas, cada una con una cadena "pesada" (CH) o larga y una cadena "ligera" o corta (CL). Las dos cadenas de cada par están unidas entre sí por un puente disulfuro formado entre los átomos de azufre de los aminoácidos cistina. Si estos enlaces disulfuro se rompen, las cadenas pesada y ligera permanecen unidas entre sí por interacciones no covalentes. Cuando se introducen en una solución de ácido o urea, se disocian, sin embargo, en cadenas pesadas y ligeras, las cuales pueden separarse por su diferente tamaño. Cuando las moléculas de IgG se tratan con papaína, la molécula se divide en tres partes de tamaño aproximadamente igual. Dos de ellas son iguales y reciben el nombre de Fab (de "fragment, antigen-binding", fragmento de unión con el antígeno}. Cada fragmento Fab de una molécula de IgG posee un lado de unión. La molécula intacta de anticuerpo tiene dos de dichos lados, por lo cual puede ligar materiales antigénicos para formar complejos inactivos. El tercer fragmento resultante de la digestión por la papaína se llama Fc, puesto que cristaliza rápidamente ("fragment crystalline"). No se une al antígeno, pero posee otras importantes actividades biológicas. El modelo de IgG aceptado es el de una Y, cuyos brazos están formados por los Fab y el tronco por el Fc (*). Los brazos de la Y constan cada uno de una cadena ligera entera y de un resto de la cadena pesada. La unidad Fc y las dos unidades Fab de la molécula intacta del anticuerpo se juntan por medio de una bisagra que permite variar el ángulo entre las unidades. Las dos zonas situadas en la punta de cada fragmento Fab (VH y VL) varían en la secuencia de aminoácidos según la especificad de los anticuerpos y se llaman zonas variables. Además, cada cadena pesada tiene tres zonas globulares que no cambian y que reciben el nombre de zonas constantes (CH1, CH2 y CH3). Por su parte, las cadenas ligeras también tienen una zona globular constante que recibe el nombre de CL |
|
REFERENCIAS GM Edelman: Estructura y función de los anticuerpos. En Inmunología. Ed. Labor, 1983 p42-51 |
||