![]()
DESCRIPCION
El metotrexato (también llamado ametopterina) es un antimetabolito de la familia de los folatos. Es un análogo de la aminopterina, producto que también deriva del ácido fólico.
El metotrexato fue utilizado inicialmente, en 1948 en el tratamiento de la leucemia linfocítica de la infancia, y desde entonces, ha sido empleado contra numerosas enfermedades malignas, incluyendo osteosarcomas, linfoma no de Hodgkin, enfermedad de Hodgkin, linfoma cutáneo de células T (micosis fungoides) y cánceres de cabeza y de cuello. El metotrexato es uno de los pocos fármacos que puede ser administrado intratecalmente en los casos de metástasis que afecten el sistema nervioso central.
El metotrexato también posee efectos inmunosupresores y es utilizado en el tratamiento de la artritis reumatoide, en la prevención de la enfermedad injerto contra huésped y en otras enfermedades autoinmunes como la psoriasis.
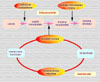
Mecanismo de acción: el metotrexato inhibe competitivamente la dihidrofolato-reductasa, enzima responsable de convertir el ácido fólico a tetrahidrofolato, el cofactor necesario para la transferencia de un carbono en muchas reacciones metabólicas. Algunas de estas reacciones afectan la proliferación celular, incluyendo la síntesis de ácido timidílico y de los precursores nucleótidos del DNA y RNA. La inhibición de la timidilato-sintasa es, quizás, el efecto más importante del metotrexato resultando en una inhibición de la síntesis del DNA. Los efectos inhibidores del metotrexato dependen de sus concentraciones intracelulares, y los tejidos con mayor metabolismo celular y crecimiento más rápido son los más afectados. Entre estos, se encuentran los tejidos neoplásicos, los folículos capilares, las células epiteliales del tracto digestivo y las células de la médula ósea. El metotrexato inhibe la proliferación celular en las fase S del ciclo celular. En dosis altas (> 30 mg/m2) el metotrexato inhibe las células en la fase S y ralentiza la entrada desde G1 a S.
Adicionalmente, el metotrexato puede inhibir la síntesis de proteínas debido a la reducción que experimentan los cofactores del folato, siendo este posiblemente el mecanismo por el cual las dosis altas de metotrexato paran las células en la fase G1. Un factor crítico sobre los efectos citotóxicos del metotrexato es la duración de la exposición al mismo, por lo que una exposición prolongada, incluso a dosis bajas, puede producir una citotoxicidad y toxicidad significativas. El metotrexato penetra en las células utilizando 2 sistemas de transporte: el primero utiliza un transportador de folato reducido que muestra una alta afinidad hacia el metotrexato y también para los folatos reducidos, mientras que el segundo consiste en una difusión pasiva. Este último mecanismo no reviste gran importancia a menos que el metotrexato se administre en dosis muy altas (concentraciones séricas > 100 mM). Una vez en el interior de la célula, el metotrexato experimenta la polimerización de la cadena lateral de ácido glutámico para formar el poliglutamato de metotrexato. Tanto el metotrexato como su derivado poliglutámico inhiben la dihidrofolato-reductasa. Sin embargo, el derivado poliglutámico, al ser de mayor tamaño resiste mejor que el metotrexato el transporte hacia afuera, mecanismo por el cual, las células se libran de productos tóxicos. La formación del derivado poliglutámico del metotrexato se lleva a cabo con mayor facilidad en las células tumorales que en las células de mamífero lo que explica la relativa selectividad del fármaco hacia las células tumorales. La formación del poliglutamato de metotrexato (PG-MTX) depende tanto de la concentración intracelular del fármaco, como de la duración de la exposición. La administración de dosis elevadas de metotrexato para originar altas concentraciones extracelulares es una forma de soslayar la aparición de resistencias que se producen durante el tratamiento convencional secundaria a los cambios en los sistemas de transporte de la membrana.
La resistencia al metotrexato se desarrolla a través de una serie de mecanismos:
- disminución de la entrada del fármaco en la célula
- reducción de la unión del metotrexato a la dihidrofolato-reductada o
- aumento de la concentración o actividad de la dihidrofolato-reductasa
- disminución de la formación del PG-MTX, lo que supone desarrollo de resistencias incluso a grandes dosis del fármaco
Los dos primeros mecanismos son los usualmente involucrados en el desarrollo de resistencia al metotrexato. La disminución de la formación del PG-MTX sólo tiene lugar cuando las exposiciones son cortas (< 24 horas)
Los blastos de la leucemia mielocítica son intrínsecamente resistentes al metotrexato. Se cree que esta resistencia se debe a que estas células retienen menos tiempo el metotrexato al ser más reducida la poliglutamación.
El metotrexato posee igualmente propiedades inmunosupresoras y también puede mostrar propiedades anti-inflamatorias. En dosis bajas, el metotrexato inhibe la proliferación y función de los linfocitos T y B, siendo capaz de suprimir la liberación de interleukina-1, interferón gamma, el factor de necrosis tumoral y otras citokinas que intervienen en la función de los neutrófilos. Así, en la psoriasis, la producción de células epiteliales que está aumentada en relación con la piel normal es reducida por el metotrexato.
Farmacocinética: el metotrexato se administra por vía oral, intravenosa, intramuscular o intratecal. Cuando se administra por vía oral, el metotrexato se absorbe en el tracto digestivo mediante un mecanismo de transporte activo, que puede saturarse si las dosis del fármaco son muy elevadas. Las dosis orales de 30 mg/m2 muestran un biodisponibilidad del 60%, reduciéndose esta si las dosis son de > 50 mg/m2. En estos casos, se aconseja dividir las dosis para evitar los procesos de saturación.
En los pacientes con leucemia, la absorción del metotrexato es muy variable. Así, después de una dosis de 20 mg/m2, se han visto diferencias en hasta 20 veces entre las concentraciones plasmáticas máximas (Cmax entre 0.11-2.3 µM). Por otra parte, el metotrexato oral experimenta un metabolismo de primer paso en el hígado lo que limita su biodisponibilidad. Los alimentos retrasan la absorción y reducen las Cmax.
Por vía intramuscular, el metotrexato es bien absorbido alcanzando las concentraciones plasmáticas máximas en un plazo de 30 a 60 minutos. Después de la inyección intratecal, el metotrexato pasa lentamente a la circulación general. El volumen de distribución es similar al volumen total de agua. El metotrexato se une a las proteínas del plasma en un 50-60%, sobre todo a la albúmina. Por ser un ácido débil es desplazado de su unión a las proteínas por otros ácidos débiles tales como el ácido acetil-salicílico, las tetraciclinas, el cloramfenicol o las sulfonamidas.
El metotrexato difunde lentamente en los fluidos del tercer compartimento (efusiones pleurales, ascitis, etc), debiéndose evacuar estas efusiones antes de la siguiente dosis.
El metotrexato experimenta un metabolismo intracelular al poliglutamil-metotrexato (PG-MTX), pudiendo ser convertido de nuevo a metotrexato por las hidrolasas celulares. El PG-MTX puede quedar retenido en algunos tejidos durante períodos de tiempo considerables, dependiendo de la naturaleza de los tejidos y de los tumores. Una pequeña parte del metotrexato es metabolizado a 7-hidroximetotrexato, metabolito que supone entre el 7 y 33% de la excreción del fármaco en la fase terminal de eliminación. Adicionalmente, parte del metotrexato es metabolizado por la flora intestinal ocasionando un metabolito inactivo. Cuando el metotrexato es administrado en dosis bajas por vía intravenosa (30 mg/m2) aproximadamente el 10% se elimina en forma de metabolitos. Cuando la misma dosis se administra por vía oral, los metabolitos ascienden al 35% de la dosis.
La eliminación del metotrexato ocurre en tres fases: la primera fase, con una semi-vida de 45 minutos es la fase de distribución. Sigue la fase de eliminación de unas 3.5 horas consistente en la eliminación renal y, finalmente una fase terminal con una semi-vida de 10-12 horas. Esta fase refleja la distribución enterohepática del fármaco y es la que determina la toxicidad hematológica y gastrointestinal del fármaco. La principal vía de eliminación del metotrexato es la vía renal, dependiendo de la dosis y la vía de administración. La mayor parte de la dosis administrada es eliminada en la orina de 12 horas mediante un mecanismo de secreción tubular y, por tanto, algunos ácidos débiles como el probenecid o las penicilinas pueden retardar su eliminación. La excreción biliar supone aproximadamente el 10% de la dosis.
Cuando el metotrexato se administra en dosis elevadas, pueden producirse concentraciones elevadas del fármaco en orina, concentraciones que pueden exceder los límites de solubilidad del metotrexato y el 7-hidroximetotrexato, en particular cuando el pH es inferior a 7. En estos casos se recomienda la intensa hidratación del paciente y la alcalinización de la orina.
Ni la hemodiálisis
ni la diálisis peritoneal de rutina afectan el aclaramiento del
metotrexato. Sin embargo se han comunicado casos en que se consiguió
la eliminación del fármaco mediante hemodiálisis
intermitente en un dializador de alto flujo.
INDICACIONES Y POSOLOGIA
![]() Tratamiento
de la leucemia linfocítica aguda:
Tratamiento
de la leucemia linfocítica aguda:
Vías oral o intramuscular:
- Adultos y niños: 3.3 mg/m2 p.os/i.m. diariamente durante 4—6 semanas o hasta que se produzca la remisión, seguida de una dosis de mantenimiento de 20—30 mg/m2 p.os/i.m. dos veces por semana. Los niños que reciban las dosis de 20-30 mg/m2/semana (0.65—1 mg/kg/semana) pueden tener una mejor absorción y menos efectos secundarios gastrointestinales si el metotrexato se administra por vía i.m. ó s.c.
Vía intravenosa:
- Adultos y niños: 3.3 mg/m2 i.v.diariamente durante 4—6 semanas o hasta que se produzca la remisión; seguidamente se administraran dosis de mantenimiento de 2.5 mg/kg i.v.cada 14 días o 30 mg/m2 i.m. semanalmente.
En el caso de una leucemia refractaria, pueden darse dosis más altas de metotrexato (1—10 mg/m2), precedidos de una dosis de carga de de 200 mg/m2. Las concentraciones plasmáticas de metotrexato deben ser monitorizadas y debe tenerse listo un tratamiento de rescate con leucovorina
![]() Tratamiento
del linfoma no-Hodgkin y del linfoma de Burkitt:
Tratamiento
del linfoma no-Hodgkin y del linfoma de Burkitt:
Administración intravenosa:
- Adultos
y niños: se utilizan múltiples regímenes de tratamiento,
si bien los dos más comunes son el m-BACOD (metotrexato 200 mg/m2
los días 8 y 15 cada 21 días en combinación con
bleomicina, doxorrubicina, ciclofosfamida, vincristina y dexametasona)
y el Pro-MACE-CytaBOM ( (metotrexato 120 mg/m2 i.v.el día 8 cada
28 días en combinación con ciclofosfamida, doxorrubicina,
etoposide, prednisona, citarabina, bleomicina, y vincristina). Para
el tratamiento del linfoma no-Hodgkin refractario o el linfoma de Burkitt,
pueden darse dosis altas de metotrexato ((1—10 g/m2 i.v. o incluso más).
En estos casos, es necesario la leucovorina como medicación de
rescate y la monitorización de los niveles plasmáticos
de metotrexato
![]() Tratamiento del linfoma de células T cutáneo (micosis
fungoides):
Tratamiento del linfoma de células T cutáneo (micosis
fungoides):
Administración oral:
- Adultos: 2.5—10 mg al día en una dosis única.
Administración parenteral
- Adultos:
50 mg IM/i.v.una vez a la semana o 25 mg i.m./i.v. dos veces a la semana
![]() Tratamiento
de cáncer de cabeza y cuello:
Tratamiento
de cáncer de cabeza y cuello:
Administración intravenosa
- Adultos y niños: 40 mg/m2 i.v. los días 1 y 15, cada tres semanas, en monoterapia o en combinación con bleomicina y cisplatino
Administración oral
- Adultos: 25—50 mg/m2 p.os una vez a la semana
- Niños: 7.5—30 mg/m2 cada 7-14 días
![]() Tratamiento
del cáncer de vejiga:
Tratamiento
del cáncer de vejiga:
Administración intravenosa
- Adultos: 30 mg/m2 i.v. los días 1, 15, y 22 cada 4 semanas en combinación con vinblastina doxorrubicina, y cisplatino
![]() Tratamiento del cáncer de mama
Tratamiento del cáncer de mama
Administración intravenosa
- Adultos y niños: 40—60 mg/m2 i.v. administrados el día 1 cada 21—28 días en combinación con ciclofosfamida y fluoruracilo
![]() Tratamiento del cáncer de pulmón:
Tratamiento del cáncer de pulmón:
Administración intravenosa
- Adultos: se han descrito numerosos regímenes de tratamiento en los que se incluye el metotrexato. Los más usuales incluyen metotrexato 20 mg/m2 en una dosis única i.v. con cisplatino, doxorrubicina y ciclofosfamida, cada 28 días; metotrexato 40 mg/m2 en una dosis única i.v. con etoposide y cisplatino; y metotrexato 100 mg/m2 en una sola dosis i.v. con ciclofosfamida, vincristina, and doxorrubicina.
Administración oral
- Adultos: 10 mg/m2 dos veces por semana, cada 2 semanas en combinación con lomustina y ciclofosfamida.
![]() Tratamiento
o profilaxis de leucemia carcinomatosa o leucémica
Tratamiento
o profilaxis de leucemia carcinomatosa o leucémica
Administración intratecal (utilizar solo soluciones sin preservativos)
- Adultos y niños de > 3 años: 12-15 mg cada 2-7 días hasta que el líquido cefalorraquídeo vuelve a la normalidad.
- Ancianos: puede estar indicada una reducción en la dosis por ser menor el volumen del líquido cefalorraquídeo y su renovación en esta población
- Niños de 24 a 35 meses; 10 mg intratecales cada 2 a 5 días hasta retorno a la normalidad del líquido cefalorraquídeo
- Niños de 12 a 23 meses: 8 mg cada 2 a 5 días hasta normalización del líquido cefalorraquídeo
- Niños de < 12 meses: 6 mg cada 2-5 días hasta normalización del líquido cefalorraquídeo
Administración intravenosa
- Adultos y niños: dosis altas de metotrexato ((> 1 g/m2) producen concentraciones citotóxicas en el líquido cefalorraquídeo. Estas dosis suelen producir respuestas positivas en la leucemia y linfoma del SNC
![]() Tratamiento
del sarcoma osteogénico:
Tratamiento
del sarcoma osteogénico:
Administración intravenosa
- Adultos y niño: 12 g/m2 cada 2 semanas. Si estas dosis no producen unas concentraciones pico de 1000 al final de la infusión, la dosis puede aumentarse a 15 g/m2 en tratamientos subsiguientes. Estas dosis requieren leucovorina como medicación de rescate y la monitorización de las concentraciones del fármaco en la sangre
![]() Tratamiento
del cáncer de ovario:
Tratamiento
del cáncer de ovario:
Administración intravenosa
- Adultos y niños: 40 mg/m2 los días 1 y 8 cada 4 semanas en combinación con hexametilmelamina, ciclofosfamida, y fluorouracilo.
![]() Tratamiento
de neoplasmas trofoblásticos (corioadenoma destruens,
coriocarcinoma, mola hidatidiforme):
Tratamiento
de neoplasmas trofoblásticos (corioadenoma destruens,
coriocarcinoma, mola hidatidiforme):
Administración oral e intramuscular
- Adultos: 15—30 mg una vez al día durante 5 días. Repetir al cabo de una o más semanas dependiendo de la respuesta y de la toxicidad
![]() Tratamiento
de la enfermedad de Crohn
Tratamiento
de la enfermedad de Crohn
Administración intramuscular
- Adultos: se han administrado dosis de 25 mg/semana en un estudio controlado por placebo en pacientes tratados previamente con prednisona durante tres meses. Se observó una respuesta favorable al metotrexato durante las 16 semanas del estudio, permitiendo una reducción gradual de las dosis necesarias de prednisona para mantener la remisión
![]() Prevención de la enfermedad injerto frente a huésped
Prevención de la enfermedad injerto frente a huésped
Administración intravenosa
- Adultos, adolescentes, y niños 15 mg/m2 i.v. el día 1 después del trasplante y luego 10 mg/m2 i.v. los días 3, 6, and 11. Alternativamente pueden administrarse 5 mg/m2 i.v. los días 1, 3, 6, y 11 después del trasplante. A menudo, el metotrexato se combina con ciclosporina o tacrolimus y corticosteroides.
![]() Tratamiento
del embarazo ectópico
Tratamiento
del embarazo ectópico
Administración intramuscular
- Mujeres adultas: en las mujeres con la función renal normal con embarazos ectópicos intactos de < 3.5 cm, se han administrado dosis de 50 mg/m2 que han mostrado ser eficaces preservando la función reproductora. Administrando el metotrexato el día 1, se deben monitorizar los niveles séricos de gonadotropina coriónica los días 4 y 7. Si los niveles de gonadotropina no disminuyen al menos en 15% en este período, se debe repetir la dosis de metotrexato. Si después de 3 dosis de metotrexato los niveles de gonadotropina coriónica no se han reducido hasta < 15 mUI/ml, o si se observa actividad cardiaca fetal, el embarazo ectópico debe ser tratado quirúrgicamente
Cuando el metotrexato en dosis de 50 mg/m2 intramuscular se administra en combinación con mifepristona oral, se reduce el riesgo de fracaso terapéutico en comparación con el metotrexato en monoterapia
Administración intratubárica:
- Mujeres
adultas: se han utilizado dosis de 100 mg de metotrexato administradas
por inyección intratubárica transvaginal o laparoscópica
en mujeres con embarazo de < 8 semanas
![]() Tratamiento
de la psoriasis:
Tratamiento
de la psoriasis:
Administración oral y parenteral
- Adultos: 10—25 mg por vía oral, intramuscular o intravenosa en una dosis única a la semana. También se ha utilizado otro régimen consistente en 2.5-5 mg por vía oral cada 12 horas durante 1.5 días(3 dosis en total) cada semana. No deben superarse los 30 mg/semana
![]() Tratamiento
de la artritis psoriásica
Tratamiento
de la artritis psoriásica
Administración oral:
- Adultos: en un estudio abierto se administraron dosis de 5 a 7.5 mg una vez a la semana, ajustando la dosis en función de las reacciones adversas y la respuesta clínica. Una vez ajustada la dosis los pacientes fueron tratados con la misma 3 meses, transcurridos los cuales las dosis fueron rebajadas al máximo posible capaz de mantener el control. Los pacientes recibieren una media de 11.2 mg/semana durante 6 a 132 meses. La respuesta fue considerada buena o excelente en el 94% de los casos
![]() Tratamiento de la artritis reumática
Tratamiento de la artritis reumática
Administración oral
- Adultos: 7.5 mg una vez a la semana o 3 dosis de 2.5 mg a intervalos de 12 horas una vez a la semana. Las dosis se deben ajustar hasta obtener una respuesta óptima. No se recomienda exceder los 20 mg/semana. La respuesta terapéutica comienza a notarse a las 3-6 semanas de iniciar el tratamiento, alcanzándose la máxima mejoría al cabo de 12 semanas adicionales. Aunque se desconoce los efectos a largo plazo, los datos existentes indican que, con las dosis de mantenimiento recomendadas (7.5 a 15 mg/semana) la mejoría se mantiene al menos 2 años. Al discontinuar el tratamiento, la artritis empeora en un plazo de 3 a 6 semanas
![]() Tratamiento de artritis juvenil poliarticular en niños
que no responden a una terapia con AINES
Tratamiento de artritis juvenil poliarticular en niños
que no responden a una terapia con AINES
Administración oral o parenteral:
- Niños: se recomienda iniciar el tratamiento con 10 mg/m2/semana en una dosis única o la misma cantidad dividida en 3 dosis a intervalos de 12 horas, también una vez por semana. Seguidamente, las dosis se deben ajustar individualmente hasta conseguir la respuesta óptima. Se han utilizado dosis entre 4-17 mg/m2/semana con duraciones de tratamiento que han oscilado entre 1 mes y más de 7 años. Se desconoce cual es la duración óptima del tratamiento y tampoco se sabe si dosis > 20 mg/m2/semana pueden aumentar el riesgo de toxicidad. La administración intramuscular y subcutánea ocasiona menos efectos adversos gastrointestinales y una mayor absorción que las dosis orales
![]() Tratamiento
del prurito secundario a una colestasis o a una cirrosis biliar primaria
Tratamiento
del prurito secundario a una colestasis o a una cirrosis biliar primaria
Administración oral
- Adultos: en un estudio a corto plazo, dosis de 7.5—15 mg una vez a la semana redujeron el prurito en pacientes con cirrosis biliar primaria
![]() Tratamiento
de la polimiositis o dermatomiositis
Tratamiento
de la polimiositis o dermatomiositis
Administración parenteral:
- Adultos: 5—10 mg i.v./i.m. una vez a la semana. Estas dosis pueden aumentarse en incrementos de 5—10 mg hasta un máximo de 50 mg a la semana o hasta que se presenten síntomas de toxicidad
![]() Tratamiento de la sarcoidosis:
Tratamiento de la sarcoidosis:
Administración oral:
- Adultos: varias publicaciones han documentado la eficacia del metotrexato en la sarcoidosis dependiente de esteroides. En un caso, los pacientes fueron tratados con 10 mg por vía oral una vez a la semana (rango de dosis entre 7.5—15 mg/semana) durante una media de 30 meses, observándose una mejora de todos los pacientes lo que permitió reducir las dosis de corticoides. En otro estudio en el que el metotrexato se administró en dosis personalidades durante 2 años, un 70% de los pacientes mostró una mejoría de su estado general
Dosis máximas recomendadas
La dosis máxima recomendada de metotrexato depende de la enfermedad, del estado general del paciente, de que se administren al mismo tiempo otros quimioterápicos o radiación. Antes de iniciar cualquier tratamiento se recomienda consultar los diversos protocolos y las referencias adecuadas
- Adultos:
- Psoriasis: 30 mg/semana por vía oral.
- Artritis reumatoide: 20 mg/semana por vía oral
- Enfermedades neoplásicas: las máximas dosis toleradas varían desde 80-900 mg/m2 i.v. sin leucovorina como medicación de rescate hasta 900-30.000 mg/m2 con leucovorina
- Máximas dosis intratecales: 15 mg
- Ancianos: las dosis máximas recomendadas son las mismas que las de los adultos
- Niños: en el tratamiento de las enfermedades neoplásicas las dosis máximas toleradas varían entre 90 y 900 mg/m2 por vía intravenosa sin leucovorina como medicación de rescate y entre 900 y 30.000 mg/m2 con la leucovorina. Las máximas dosis toleradas por vía intratecal son de 15 mg.
Por vía oral no se recomiendan dosis menores de 30 mg/m2 debido a la baja absorción gastrointestinal del fármaco.
- Pacientes con insuficiencia renal: en general, en los pacientes con aclaramiento de creatinina < 60 ml/min está contraindicada la administración de dosis elevadas y medias de metotrexato. Las dosis del fármaco se deben ajustar de acuerdo con los siguientes valores para el ClCr:
- ClCr > 80 ml/min: no es necesario un reajuste de la dosis
- ClCr 70-79 ml/min: administrar el 75% de la dosis estándar
- ClCr 60-69 ml/min: administrar el 63% de la dosis estándar
- ClCr: 50-50 ml/min: administrar el 56% de la dosis estándar
- ClCr < 50 ml/min; considerar otro tratamiento
- Pacientes con insuficiencia hepática: no se recomienda la administración de metotrexato para el tratamiento de la psoriasis o de la artritis reumatoide. En otras indicaciones hay que tener presenta que los pacientes con insuficiencia hepática muestran una semi-vida más prolongada del metotrexato, y por lo tanto, requieren una mayor monitorización y un tratamiento con leucovorina.
Monitorización del metotrexato: la determinación de los niveles plasmáticos de metotrexato solo es necesaria cuando el fármaco forma parte de una combinación quimioterápica, en los pacientes que hayan mostrado síntomas de toxicidad al fármaco o en el caso de insuficiencia renal. Usualmente no es necesaria la monitorización de los niveles plasmáticos del metotrexato si las dosis son < 100 mg/m2 a menos que el paciente padezca insuficiencia renal o tolere mal el fármaco. Si los niveles plasmáticos del fármaco son > 0,1 µM durante más de 42 horas, puede ser necesaria la administración de leucovorina para evitar o minimizar la toxicidad hematológica o gastrointestinal ( 1 µM de metotrexato = 0.454 mg/ml).
Cuando el
metotrexato se administra en dosis de > 1000 mg/m2, se recomienda monitorizar
los niveles plasmáticos a las 24 y 48 horas, continuando la monitorización
hasta que los niveles en sangre son < 0.05 mM.
PRECAUCIONES PARA LA ADMINISTRACION
Tomar las
precauciones usuales en la manipulación, preparación y administración
de los fármacos citotóxicos. Debe evitarse el contacto del
fármaco con los ojos y las mucosas
CONTRAINDICACIONES Y PRECAUCIONES
Debido a
la frecuencia e intensidad de las reacciones adversas, el metotrexato
será administrado únicamente por profesionales con experiencia
en el manejo de los fármacos antineoplásicos. Los pacientes
deben ser informados acerca de las reacciones adversas que pueden experimentar.
Los pacientes mayores y los pacientes con insuficiencia renal están
mas expuestos a las reacciones adversas del metotrexato.
El metotrexato produce la muerte o malformaciones fetales, por lo que no debe ser utilizado bajo ningún concepto durante el embarazo (grupo X de riesgo según la clasificación de la FDA). Se recomienda que los mujeres con posibilidad de quedarse embarazadas no utilicen el metotrexato, a menos los beneficios del tratamiento superen el riesgo potencial de un embarazo. El embarazo tiene que ser igualmente evitado si es la pareja la que se encuentra bajo tratamiento con metotrexato. Igualmente, se debe evitar el embarazo en los tres meses siguientes a la discontinuación del tratamiento. Los pacientes deben ser advertidos del riesgo de un embarazo y utilizar medidas contraceptivas adecuadas.
El metotrexato
se excreta en la lecha materna (proporción leche/plasma, 0.08)
debiéndose evitar la lactancia durante su administración.
El
metotrexato está contraindicado en pacientes con psoriasis o artritis
reumatoide que muestren una supresión persistente de la médula
ósea, representada por leucopenia, trombocitopenia, o anemia significativa.
Igualmente, si durante un tratamiento se origina una supresión
de la médula ósea el metotrexato debe ser inmediatamente
retirado. En los pacientes con una enfermedad neoplásica, se debe
esperar a que se recupere la función medular antes de iniciar un
nuevo ciclo con metotrexato. No obstante, el tratamiento con metotrexato
está indicado en la leucemia aguda, independientemente de una profunda
supresión medular. Los pacientes que muestren una grave neutropenia
y fiebre deben ser evaluados de inmediato: por lo general requieren antibióticos
de amplio espectro.
La presencia de pancitopenia incluyendo leucopenia, neutropenia y trombocitopenia contraindica la administración de un nuevo ciclo con metotrexato. En estos casos, la administración del fármaco se debe retrasar hasta que el recuento hematológico muestra un recuento de leucocitos > 1500/mm3, > 200 neutrófilos/mm3 y > de 75.000 plaquetas/mm3.
Si durante un tratamiento con metotrexato se desarrollase un infección, debe considerarse la interrupción del tratamiento, o por lo menos, una reducción de la dosis. Los pacientes con mayor riesgo de padecer una infección son los que tienen historia de varicela, infecciones por herpes u otras enfermedades víricas. Los pacientes con psoriasis o artritis reumatoide que muestren un síndrome de inmunodeficiencia no debe ser tratados con metotrexato.
El metotrexato puede ocasionar efectos pulmonares adversos como neumonitis o fibrosis pulmonar. Se debe discontinuar el tratamiento si el paciente muestra síntomas de una enfermedad pulmonar tales como tos, fiebre, disnea, dolor torácico o hipoxemia, o si se aprecian en las radiografías infiltrados pulmonares. La diabetes mellitus, la edad avanzada, el uso de otros fármacos modificadores de la enfermedad reumática, la sulfasalazina, las sales de oro y la penicilamina son factores de riesgo adicionales para el desarrollo de una enfermedad pulmonar.
El metotrexato es metabolizado en el hígado, experimentando una circulación enterohepática, por lo que debe ser administrado con precaución a pacientes con enfermedades hepáticas. Los pacientes con psoriasis o artritis reumatoide con alcoholismo, u otra enfermedad hepática no deberán ser tratados con metotrexato. La hepatotoxicidad del metotrexato depende de las dosis acumuladas del fármaco, aumentando en la diabetes, obesidad, edad avanzada y alcoholismo. Los enfermos con psoriasis que reciban un tratamiento con metotrexato deberán ser monitorizados en su función hepática, aunque solo la biopsia hepática es capaz de revelar la toxicidad del fármaco. En presencia de una cirrosis o fibrosis moderada se debe discontinuar la administración del metotrexato. Por el contrario, en los pacientes con artritis, los tests anormales de la función hepática son indicadores de una hepatotoxicidad. Durante un tratamiento de la artritis con metotrexato se recomienda la determinación periódica de los indicadores de la función hepática, discontinuando el tratamiento si estos indicadores se mantuvieran persistentemente anormales.
Los efectos mielosupresores del metotrexato aumentan el riesgo de hemorragias y de infecciones. Por lo tanto cualquier intervención odontológica deberá esperar hasta que los recuentos sanguíneos se hayan normalizado. Tampoco se deberán administrar inyecciones intramusculares si el recuento de plaquetas es < 50,000/mm3. Las inyecciones intramusculares pueden ocasionar hemorragias y hematomas cuando se administran a pacientes con trombocitopenia.
Algunos preparados inyectables de metotrexato contiene como preservativo alcohol bencílico y no se deben inyectar intratecalmente en pacientes con hipersensibilidad a este producto o en los neonatos.
Durante el tratamiento con metotrexato puede ocurrir el síndrome de la lisis tumoral. Para evitar la hiperuricemia, se deben tomar las medidas apropiadas (hidratación agresiva y administración de alopurinol) en particular si el tumor es de gran tamaño. La hiperuricemia resultante puede provocar gota o nefrolitiasis por uratos.
El metotrexato se debe utilizar con precaución en pacientes con enfermedades gastrointestinales tales como úlcera péptica o colitis ulcerativa. Si se produjeran vómitos, diarrea o estomatitis que pudieran producir una deshidratación se deberá suspender el tratamiento hasta que el paciente se recupere.
El metotrexato es un radiosensibilizante, por lo que su administración durante la radioterapia aumenta el riesgo de necrosis tisular y ósea. La irradiación de la cabeza antes o durante un tratamiento con metotrexato ha sido asociada a leucoencefalopatías. Igualmente, las lesiones psoriásicas pueden agravarse por el uso concomitante de metotrexato y radiación UV.
INTERACCIONES
La leucovorina es un folato reducido que, al administrarse con el metotrexato, circunvala el bloqueo enzimático intracelular producido por este último y permite que la síntesis de DNA tenga lugar. Por este motivo, la leucovorina se utiliza como agente de rescate para reducir la toxicidad del metotrexato en los tejidos normales. La monitorización de los niveles de metotrexato determinará las dosis apropiadas y la duración del tratamiento con leucovorina. Si las dosis de leucovorina no son las adecuadas, el metotrexato puede producir una excesiva toxicidad hematológica y gastrointestinal.
La leucovorina parece interferir poco en la respuesta de las células tumorales al metotrexato; en efecto, las células tumorales tienen una mayor formación de poliglutamato de metotrexato y son más resistentes a la acción de la leucovorina. El ácido fólico (vitamina B9) no es efectivo como fármaco de rescate contra el metotrexato, dado que necesita para su bioactivación de una enzima, la dihidrofolato-reductasa, que es inhibida por el metotrexato. Por lo tanto, no se debe utiliza el ácido fólico para prevenir la toxicidad del metotrexato. En ningún caso, se debe aplicar a la leucovorina el nombre de "ácido folínico". Además, el ácido fólico puede competir con el metotrexato a la hora de entrar en las células.
Los fármacos anti-inflamatorios no esteroídicos (AINES), no se deben administrar antes, al mismo tiempo o después de dosis altas de metotrexato. La administración concomitante de AINES con metotrexato aumenta y prolonga las concentraciones séricas del mismo, pudiendo ocasionar la muerte como resultado de una severa toxicidad hematológica y gastrointestinal. Cuando se administran dosis bajas de metotrexato, se deben tomar precauciones si se prescriben simultáneamente anti-inflamatorios no esteroídicos. Se han administrado AINES conjuntamente con metotrexato a pacientes con artritis reumatoide sin problemas aparentes. Debe hacerse la observación, de que las dosis de metotrexato utilizadas en el tratamiento de la artritis reumatoide son menores que las utilizadas en los casos de enfermedades malignas o psoriasis. Son estas dosis más altas las que pueden ocasionar episodios inesperados de toxicidad si se administran al mismo tiempo anti-inflamatorios no esteroídicos.
En general, los AINES reducen el aclaramiento del metotrexato, lo que resulta en unos niveles séricos más altos y prolongados de metotrexato. Además, el uso concomitante de los AINES y del metotrexato aumenta el riesgo de una sangrado gastrointestinal en pacientes con trombocitopenia inducida por el metotrexato.
La interacción potencial entre el metotrexato y el celecoxib o rofecoxib no ha sido evaluada. Por lo tanto, se recomienda vigilar cuidadosamente a los pacientes en lo que se refiere a los síntomas tóxicos del metotrexato si se administran al mismo tiempo estos fármacos. En un pequeño estudio, la farmacocinética del metotrexato no fue afectada por el celecoxib en pacientes artríticos tratados con la dosis de mantenimiento de metotrexato. Por el contrario, se ha comunicado que el rofecoxib reduce el aclaramiento del metotrexato.
Se deben tomar precauciones cuando se administren salicilatos en combinación con el metotrexato. Ambos tipos de compuestos son ácidos débiles por lo que los salicilatos pueden afectar la secreción tubular renal del metotrexato, aumentando el riesgo de toxicidad. Además, los salicilatos pueden desplazar al metotrexato de su unión a las proteínas del plasma, lo que incrementa también los efectos tóxicos. Aunque el riesgo de una toxicidad por metotrexato es mayor cuando se administran dosis altas, se recomienda una vigilancia cuidadosa en enfermos con artritis a los que administren al mismo tiempo salicilatos y dosis bajas de metotrexato. Se ha observado una incidencia significativamente mayor de leucopenia en los pacientes que recibieron salicilatos durante el tratamiento con metotrexato. Además, los salicilatos en grandes dosis (> 6 g/día) pueden causar hipoprotrombinemia, un factor de riesgo de sangrado adicional en los pacientes con trombocitopenia debida al metotrexato.
El metotrexato se encuentra parcialmente unido a las proteínas del plasma, por lo que los fármacos que se unen fuertemente a las proteínas del plasma, pueden desplazarlo aumentando el riesgo de toxicidad. Los fármacos como las sulfonilureas orales, la fenitoína o las sulfonamidas pueden causar serios problemas, aún cuando el metotrexato se administre en dosis bajas como ocurre en la artritis reumática.
Por su parte, el trimetoprim-sulfametoxazol, puede mostrar además, efectos aditivos antifolato aumentando la supresión de función de la médula ósea, debidos al trimetoprim.
Los antibióticos orales como las tetraciclinas, el cloramfenicol o los macrólidos pueden reducir la absorción intestinal del metotrexato o interferir con su circulación enterohepática al suprimir la flora intestinal, lo que reduce el metabolismo del fármaco por las bacterias. Además, el cloramfenicol y las tetraciclinas pueden desplazar al metotrexato de las proteínas del plasma a las que se encuentra unido. Se han descrito casos de toxicidad cuando se administró doxiciclina a pacientes tratados con altas dosis de metotrexato.
Las penicilinas pueden reducir el aclaramiento renal del metotrexato, habiéndose observado concentraciones séricas más altas de metotrexato cuando se administraron penicilinas. Cuando se administren estos antibióticos a pacientes bajo tratamiento con metotrexato, estos se deberán vigilar cuidadosamente para evitar episodios tóxicos.
De igual manera, el probenecid reduce la eliminación renal del metotrexato, disminuyendo su secreción tubular. También se ha observado que el probenecid disminuye el aclaramiento del metotrexato del líquido cefalorraquídeo. Los pacientes que reciban esta combinación de fármacos, deberán ser cuidadosamente vigilados.
Los fármacos nefrotóxicos como la amfotericina B, los antibióticos aminoglucósidos y el cisplatino pueden interferir con la eliminación renal del metotrexato. También se ha comunicado que la amfotericina B puede afectar la estructura de la membrana celular, lo que resulta en un aumento de la penetración del metotrexato en las células.
Se ha comunicado que el omeprazol retrasa la eliminación del metotrexato, debido probablemente a que el omeprazol interfiere con una ATPasa renal. Aunque solo se ha observado un caso, se deberán tomar precauciones si se administran inhibidores de la bomba de protones conjuntamente con el metotrexato, en particular cuando se utilizan altas dosis de este.
Los pacientes que reciban fármacos hepatotóxicos tienen un mayor riesgo de toxicidad hepática cuando se tratan al mismo tiempo con metotrexato. Así, el etretinato ha mostrado aumentar las concentraciones séricas de metotrexato y producir fetotoxicidad. Adicionalmente, del uso concomitante de retinoides y metotrexato puede resultar una fotosensibilidad aditiva. El metotrexato puede aumentar los efectos fotosensibilizantes de los fármacos empleados en la terapia fotodinámica.
El uso simultáneo del metotrexato con otros agentes que producen inmunosupresión o que afectan a la médula ósea tales como los fármacos antineoplásicos o los inmunosupresores, puede ocasionar efectos aditivos. En algunos casos, estos efectos pueden ser beneficiosos, como por ejemplo en el caso del infliximab. Cuando este anticuerpo monoclonal se administró a pacientes inmunosuprimidos con metotrexato, se redujo notablemente la producción de anticuerpos al infliximab en comparación con los pacientes no inmunosuprimidos. Además, la incidencia de reacciones adversas relacionadas con la infusión de infliximab fue menor en estos pacientes. Los pacientes con artritis reumatoide que recibieron metotrexato en combinación con infliximab mostraron unos mayores niveles séricos de infliximab en comparación con los que recibieron el anticuerpo monoclonal solamente. Sin embargo, se desconoce el impacto que pueda tener una inmunosupresión con metotrexato e infliximab sobre el desarrollo de enfermedades malignas.
Se han comunicado interacciones entre varios corticosteroides y metotrexato. La hidrocortisona ha mostrado reducir la síntesis de timidilato por el metotrexato y disminuir la citotoxicidad de este in vitro. La prednisona bloquea la inhibición de la síntesis de DNA inducida por el metotrexato. La dexametasona y la prednisolona, por el contrario, no interfieren con la citotoxicidad del metotrexato.
La respuesta inmune de los pacientes inmunosuprimidos a las vacunas es muy reducida por lo se requieren dosis más altas y más frecuentes. Aún así, la inmunización resultante puede no ser óptima. Las vacunas con virus vivos están contraindicadas durante el tratamiento con antineoplásicos o inmunosupresores que podrían potenciar la replicación del virus. De igual forma, los pacientes tratados con metotrexato u otros inmunosupresores no deben ser expuestos a personas que hayan recibido recientemente la vacuna oral contra el poliovirus. Antes de ser vacunados, los pacientes deberán esperar entre 3 meses y un año después de la discontinuación del tratamiento.
El metotrexato y el 5-fluorouracilo inhiben la síntesis de la deoxitimidina monofosfato y trifosfato mediante mecanismos diferentes pero parecidos, siendo posibles varios tipos de interacciones. El metotrexato administrado 3—24 horas antes que el 5-fluoruracilo aumenta la formación de flurouridina-trifosfato y la mortalidad celular. El metotrexato inhibe la síntesis de novo de las purinas ocasionando un aumento del fosforibosilpirofosfato, que entonces puede ser utilizado para la conversión de 5-fluoruracilo a fluorouracilo- monofosfato que se incorpora al RNA más rápidamente. Adicionalmente, el pretratamiento con metotrexato reduce los niveles de folatos reducidos que necesita la fluorodeoxiuridina-monofosfato para unirse a la timidilato-sintasa. El pretratamiento con metotrexato también resulta en la acumulación de deoxiuridina monofosfato que compite con la fluorodeoxiuridina monofosfato para unirse a timidilato-sintasa.
Cuando el 5-fluoruracilo se administra antes que el metotrexato (0—24 horas), la citotoxicidad del metotrexato es disminuida. Dado que el 5-fluoruracilo inhibe la timidilato-sintasa, la conversión de los folatos reducidos a FH2, que es inhibidor de la síntesis de novo de las purinas, es bloqueada.
La secuencia más favorable es, por lo tanto, la administración del metotrexato previa a la del 5-fluoruracilo, lo que incrementa la toxicidad de este hacia el RNA.
La L-asparaginasa ha mostrado efectos terapéuticos sinérgicos o antagonistas con el metotrexato según la pauta utilizada para la administración de ambos fármacos. Cuando el metotrexato se administra 3-24 horas antes que la L-asparaginasa, la L-asparaginasa bloquea los efectos antifolato del metotrexato y reduce su toxicidad. Las células se hacen refractarias al metotrexato durante los 10 días siguientes a una dosis única de L-asparaginasa.
Por el contrario, durante el período que sigue a la inhibición que produce la L-asparaginasa sobre la síntesis de proteínas, la síntesis del DNA está aumentada lo que conduce a una mayor sensibilidad de las células al metotrexato. Se recomienda, por lo tanto, administrar la L-asparaginasa al menos 10—14 días antes que el metotrexato, o poco después.
El metotrexato mejora la actividad citotóxica de citarabina, ya sea su administración previa o posterior a la de esta. El mecanismo por el cual el metotrexato potencia la citarabina es desconocido. Sin embargo, algunos estudios clínicos en los que la citarabina y el metotrexato fueron administrados concomitantemente por infusión a niños con leucemia no han mostrado efectos beneficiosos de la combinación.
La vincristina administrada entre 0—1 horas antes que el metotrexato bloqueó la salida del metotrexato de las células. La administración de vincristina a las 8-48 horas de la administración del resulta en una mejora de los efectos terapéuticos del metotrexato y de su recaptación por las células. Cuando el metotrexato se utiliza con la 6-mercaptopurina, se observa un incremento del 30% en los niveles plasmáticos de esta.
Debido a los efectos trombocitopénicos del metotrexato cuando se usa como fármaco antineoplásico, puede producir un riesgo aditivo de sangrado en los pacientes que reciban un tratamiento anticoagulante, trombolítico o antiagregante plaquetario con aspirina, cloruro estroncio-89 u otros fármacos. Así, se ha observado una incidencia de trombocitopenia significativamente mayor en los pacientes que tomaron aspirina durante un tratamiento con metotrexato.
El metotrexato administrado antes que la ciclofosfamida ha mostrado retardar la biotransformación y probablemente la activación de este fármaco, mejorando su eficacia. Por este motivo, la combinación de ciclofosfamida-metotrexato forma parte de muchas pautas de tratamiento de cánceres (conjuntamente con 5-fluoruracilo, con etoposide-dexametasona, etc)
La administración concurrente de etoposide o de teniposide con metotrexato resulta en una reducción del salida del metotrexato fuera de las células y, en una recirculación del mismo. Tanto la eficacia como la toxicidad del metotrexato pueden aumentar en estas combinaciones. Los resultados parecen ser mejores cuando el etoposide se aplica 3 horas antes que el metotrexato.
Estudios in vitro, han puesto de manifiesto que el alopurinol administrado una hora antes del metotrexato puede reducir los efectos terapéuticos de este. Esta alteración de la actividad antitumoral puede ser debida a una reducción del catabolismo del purinas producida por el alopurinol, un potente inhibidor de la xantina-oxidasa. Se desconoce el impacto clínico de esta interacción.
El metotrexato puede reducir el aclaramiento de la teofilina, por lo que es conveniente monitorizar los niveles de este fármaco si se administra concomitantemente con el metotrexato. En un estudio en pacientes con leucemia o linfoma y neurotoxicidad producida por el metotrexato, la teofilina atenuó los síntomas de neurotoxicidad. En algunos estudios farmacológicos, la teofilina ha mostrado reducir marcadamente los efectos antirreumáticos del metotrexato en un modelo de artritis reumatoide en la rata. Se desconoce la significancia clínica de esta interacción.
La administración concomitante de metotrexato con azatioprina o sulfasalazina puede aumentar el riesgo de hepatotoxicidad. Por otra parte, no se han comprobado beneficios terapéuticos de la combinación de ambos fármacos, al menos en la artritis reumatoide. Se ha asociado el uso concomitante del metotrexato con otros fármacos antirreumáticos (sales de oro, penicilamina y sulfasalazina) con una mayor incidencia de la toxicidad pulmonar inducida por el metotrexato.
Datos preliminares señalan que cuando se co-administran metotrexato y ciclosporina a enfermos con artritis reumatoide, las concentraciones de metotrexato aumentan en un 30%, mientras que las de su metabolito hidroxilado disminuyen en un 80%. Las concentraciones de ciclosporina no parecen alterarse. Se desconoce el significado clínico de esta interacción, dado que amplios estudios clínicos con la combinación de ambos fármacos en la artritis reumatoide han mostrado, por regla general, una mejor eficacia sin aumento sustancial de las reacciones adversas.
El tacrolimus ha sido administrado en combinación con el metotrexato para la prevención del rechazo en el trasplante de médula ósea, en la artritis reumatoide y en la enfermedad de injerto contra huésped. En general, la combinación produjo una eficacia terapéutica superior a la de los fármacos individuales, sin un aumento significativo de las reacciones adversas.
Debido a sus efectos tóxicos sobre las células progenitoras hematopoyética de crecimiento rápido, el metotrexato, como otros fármacos antineoplásicos, no se debe utilizan concomitantemente con productos que inhiben los factores de crecimiento de estas células como son el filgrastim, el sargamostim, y otros fármacos similares.
Algunos fármacos antineoplásicos han mostrado reducir la absorción de los comprimidos de digoxina debido a sus efectos sobre las mucosas del tracto digestivo. La disminución de la absorción resulta en unos niveles plasmáticos de digoxina un 50% menores que los del pretratamiento, niveles que han sido clínicamente significativos en algunos pacientes. Para evitar esta interacción deben elegirse formulaciones de digoxina en cápsulas y monitorizar frecuentemente a los enfermos para detectar precozmente cualquier pérdida de eficacia de la digoxina si se tratan al mismo tiempo con metotrexato.
La administración del metotrexato oral con las comidas puede retrasar su absorción y reducir sus concentraciones plasmáticas, Se recomienda administrar el metotrexato oral una hora antes o dos horas después de las comidas.
Debido a su potencial hepatotoxicidad no se recomienda el consumo de bebidas alcohólicas durante el tratamiento con metotrexato.
REACCIONES ADVERSAS
En general, la incidencia y la gravedad de las reacciones adversas producidas por el metotrexato son dependientes de las dosis y de la frecuencia de las mismas.
Las reacciones adversas que se observan con mayor frecuencia son la estomatitis ulcerativa, náuseas/vómitos y molestias abdominales. Las náuseas y vómitos empeoran con las dosis altas y requieren una premedicación con antagonistas de la serotonina y corticosteroides. Aproximadamente el 10% de los pacientes con psoriasis o artritis reumatoide tratados con metotrexato experimentan este tipo de reacciones adversas.
La estomatitis es también muy frecuente cuando se emplean dosis elevadas de metotrexato: los primeros síntomas aparecen a los 3-5 días de un tratamiento. La estomatitis se presenta en un 20% de los pacientes con enfermedades malignas tratados con metotrexato, pudiendo ser minimizada si se administran unas dosis adecuadas de leucovorina.
Otros efectos secundarios gastrointestinales incluyen gingivitis, glositis, faringitis, anorexia, diarrea, hematemesis, sangrado GI incluyendo melena, perforación G I, enteritis, y pancreatitis. En el caso de vómitos y diarrea intensos puede producirse una deshidratación. Las reacciones adversas digestivas pueden ser el factor limitante de las dosis a utilizar en un tratamiento oncológico.
Después de un tratamiento con metotrexato y dependiendo de la dosis y pauta de tratamiento aparece rápidamente la supresión de la médula ósea. El metotrexato puede suprimir la hematopoyesis produciendo anemia, leucopenia, neutropenia, pancitopenia y/o trombocitopenia. La neutropenia alcanza usualmente su efecto máximo a los 4-10 días, recuperándose entre los días 14-21. La trombocitopenia alcanza su máximo a los 5-13 días. La mayor disminución de la hemoglobina se observa después de 6-10 días. La función hematológica debe ser monitorizada durante un tratamiento con metotrexato, permitiendo que esta se recupere antes de iniciar un nuevo tratamiento. La administración previa de leucovorina minimiza la supresión medular. Además, la mielotoxicidad puede ser mayor en pacientes con alteraciones de la función renal.
Raras veces se han comunicado casos de hipogammaglobulinemia después de un tratamiento con metotrexato.
El metotrexato puede causar una elevación de las enzimas hepáticas y hepatotoxicidad representada por fibrosis portal y cirrosis. En el 15% de los pacientes con psoriasis o artritis reumática se produce un aumento de las transaminasas. Estos incrementos suelen ser pasajeros y asintomáticos y no son predictores de una enfermedad hepática subsiguiente. Sin embargo, el uso prolongado de metotrexato puede conducir a una hepatotoxicidad crónica, potencialmente fatal. Se han desarrollado casos de hepatotoxicidad después de tratamientos > 2 años y dosis acumuladas de > 1.5 g. Como las pruebas de la función hepática pueden ser normales durante un tratamiento prolongado con metotrexato independientemente de que se esté desarrollando una fibrosis o cirrosis, se recomiendan llevar a cabo periódicamente biopsias hepáticas.
En los pacientes con enfermedades neoplásicas tratados con > 1 g/m2 de metotrexato puede desarrollarse una hepatitis química, si bien esta reacción adversa no es frecuente. Igualmente, en estos pacientes pueden desarrollarse enfermedades oportunísticas graves. La neumonía por Pneumocystis carinii es la infección más frecuente. En cualquier paciente con sintomatología pulmonar se debe considerar la posibilidad de una infección por dicho germen. También se han comunicado otras infecciones bacterianas, fúngicas y víricas, cuya gravedad aumenta a medida que es mayor la mielosupresión del paciente.
Se ha observado ocasionalmente un síndrome neurológico similar al síndrome neurológico maligno en algunos pacientes tratados con dosis elevadas de metotrexato. Las manifestaciones de una encefalopatía pueden incluir confusión, hemiparesia, convulsiones y coma.
Se han comunicado serios efectos neurotóxicos manifestados por convulsiones focales o generalizadas en niños con leucemia linfoblástica aguda tratados con 1 g/m2 de metotrexato. La retirada del fármaco no siempre resulta en una recuperación total.
Con dosis bajas de metotrexato se han descrito ocasionalmente episodios de disfunción cognitiva, alteraciones del estado de ánimo, leucoencefalopatías y encefalopatías, reacciones adversas que requieren medidas de soporte. La leucoencefalopatía crónica ha sido asociada sobre todo a pacientes que recibieron 2 o 3 tratamientos con metotrexato sistémico, metotrexato intratecal e irradiación craneal. Para el tratamiento de la leucoencefalopatía inducida por el metotrexato se utilizan altas dosis de leucovorina o teofilina.
La administración intratecal de metotrexato puede producir síntomas de neurotoxicidad que se manifiestan como cefaleas, dolor de espalda, rigidez de la nuca y fiebre. También puede producirse una mielopatía subaguda caracterizada por paraparesis/paraplejia afectando a una o varias raíces espinales. La reacción adversa más usual es una aracnoiditis química y se encuentra probablemente relacionada con las concentraciones máximas que alcanza el metotrexato en el líquido cefalorraquídeo.
Puede ocurrir una leucoencefalopatía desmielinizante necrotizante meses o años después de una terapia con metotrexato. Esta enfermedad se caracteriza por un deterioro neurológico progresivo que puede llegar a ser fatal.
Se han descrito neumonitis intersticiales que pueden llegar a ser fatales y enfermedad pulmonar intersticial obstructiva durante el tratamiento con metotrexato. La aparición de síntomas pulmonares (incluyendo tos seca no productiva o neumonitis inespecífica) puede ser indicativa del desarrollo de una fibrosis que requiere la discontinuación del tratamiento. El paciente con enfermedades pulmonares inducidas por el metotrexato usualmente se presenta con fiebre, tos, disnea, hipoxemia e infiltrados pulmonares visibles en las radiografías. Estas lesiones pueden producirse en cualquier momento y con dosis tan bajas como las de 7.5 mg/semana.
La toxicidad renal asociada al metotrexato incluyen azoemia, cistitis, hematuria e insuficiencia renal. Estos efectos suelen ir asociados con las dosis más altas de metotrexato. La nefrotoxicidad es debido primariamente a la precipitación del metotrexato o del 7-hidroximetotrexato en los túbulos renales produciendo cristaluria y obstrucción tubular. Por este motivo, durante los tratamientos con dosis medias y altas de metotrexato, se recomienda alcalinizar la orina con bicarbonato oral o parenteral así como mantener una buena hidratación del paciente que permita mantener una excreción de orina de > 100 ml/hora. La nefrotoxicidad inducida por el metotrexato puede, a su vez, prolongar los niveles séricos del fármaco con las correspondientes reacciones adversas, en particular estomatitis y mielosupresión. Es esencial monitorizar la función renal, incluyendo los niveles de creatinina sérica, el estado de hidratación, la alcalinización de la orina y los niveles séricos de metotrexato.
Se han descrito ocasionalmente graves reacciones adversas dermatológicas, incluyendo necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, dermatitis exfoliativa, necrosis de piel y eritema multiforme en pacientes tratados con metotrexato por vía intravenosa, intramuscular, intratecal y oral, tanto en adultos como en niños. Otras reacciones adversas hematológicas son rash eritematoso, prurito, urticaria, alopecia, fotosensibilidad, equimosis, telangiectasia, acné y forunculosis. Los pacientes tratados con metotrexato evitarán la exposición al sol y se deberán proteger con filtros solares con elevados factores de protección durante al menos 15 días después de una administración.
El metotrexato puede ocasionar una pequeña supresión gonadal representada por una oogénesis defectuosa, inhibición de la espermatogénesis, oligospermia transitoria, disfunción menstrual, amenorrea, flujo vaginal, ginecomastia e infertilidad. Las alteraciones de la espermatogénesis suelen ser leves y transitorias, desapareciendo en unas pocas semanas después de discontinuar el fármaco. Después de dosis altas de metotrexato, la oligospermia puede afectar hasta al 50% de los pacientes y durar más tiempo.
La amenorrea no es muy frecuente entre las mujeres, incluso después de dosis altas. La amenorrea está relacionada con la edad de las mujeres y las que tienen más de 40 años, suelen experimentar la menopausia en el año siguiente al tratamiento con metotrexato.
Son muy raras las ocasiones en las que se ha comunicado impotencia o pérdida de la libido.
Aproximadamente en el 25% de los pacientes tratados con metotrexato se desarrolla una irritación ocular con conjuntivitis y deterioro de la visión. Esta reacción adversa comienza a la semana de iniciarse el tratamiento y desaparece una semana después de discontinuar el fármaco.
En los pacientes tratados con dosis bajas de metotrexato puede desarrollarse un linfoma que puede desaparecer al suspender la mediación sin necesidad de tratamiento.
Otras reacciones adversas más raras que se han atribuido al metotrexato incluyen vasculitis, artralgia, mialgia, osteoporosis, diabetes y reacciones anafilácticas.
PRESENTACIONES
- EMTHEXATE, 25 mg/ml. viales de 2 y 20 ml. PRASFARMA
- METOTREXATO CHIESI, 25 mg/ml. viales de 2, 20 y 40 ml CHIESI
- METOTREXATO LEDERLE, vial con liofilizado 500 mg CIANAMID IBÉRICA
- METOTREXATO LEDERLE, 25 mg/ml. viales de 2, 20 y 40 ml CIANAMID IBÉRICA
- METOTREXATO LEDERLE, comp. 2.5 mg. CIANAMID IBÉRICA
- METOTREXATO
PHARMACIA, 25 mg/ml. viales de 2 y 20 ml PHARMACIA-UPJOHN
REFERENCIAS
- Ellerby, R. Quick Reference Handbook of Oncologic Drugs, 1997. Saunders, 239 paginas
- St. Clair, E. Rheumatoide Arthritis.2004. Lippincott, 555 páginas
- Bleyer WA. The clinical pharmacology of methotrexate: new applications of an old drug. Cancer 1978;41:36—51.
- Treon SP, Chabner BA. Concepts in use of high-dose methotrexate therapy. Clin Chem 1996;42:1322—9.
- Gorlick R, Goker E, Trippett T et al. Intrinsic and acquired resistance to methotrexate in acute leukemia. N Engl J Med 1996;335:1041—8.
- Calderon E, Coffey RG, Lockey RF. methotrexate in bronchial asthma. J Allergy Clin Immunol 1991;88:274—6.
- Wall SM, Johansen MJ, Molony DA, et al. Effective clearance of methotrexate using high-flux hemodialysis membrances. Am J Kidney Dis 1996;28:846—54.
- Mullarkey MF, Lammert JK, Blumenstein BA. Long-term methotrexate treatment in corticosteroid-dependent asthma. Ann Intern Med 1990;112:577—81.
- Erzurum SC, Leff JA, Cochran JE et al. Lack of benefit of methotrexate in severe, steroid-dependent asthma. Ann Intern Med 1991;114:353—60.
- Feagan BG, Rochon J, Fedorak RN et al. methotrexate for the treatment of Crohn's disease. N Engl J Med 1995;332:292—7.
- Gazvani MR, Baruah DN, Alfirevic Z, et al. Mifepristone in combination with methotrexate for the medical treatment of tubal pregnancy: a randomized trial, controlled trial. Hum Reprod 1998;13:1987—90.
- Tzafettas JM, Stephanatos A, Loufopoulos A, et al. Single high dose of local methotrexate for the management of relatively advanced ectopic pregnancies. Fertil Steril 1999;71:1010—3.
- Hausknecht RU. methotrexate and misoprostol to terminate early pregnancy. N Engl J Med 1995;333:537—40.
- Espinoza LR, Zakraoui L, Espinoza CG, et al. Psoriatic arthritis: clinical response and side effects to methotrexate therapy. J Rheumatol 1992;19:872—7.
- Cash JM, Klippel JH. Second-line therapy for rheumatoid arthritis. N Engl J Med 1994;330:1369—75.
- Tugwell P, Bennett K, Gent M. methotrexate in rheumatoid arthritis. Ann Intern Med 1987;107:358—66.
- O'Dell JR, Haire CE, Erikson N et al. Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine, or a combination of all three medications. N Engl J Med 1996;334:1287—91.
- Fennerty MB. Primary sclerosing cholangitis and primary biliary cirrhosis; how effective is medical therapy? Postgrad Med 1993;94:81—92.
- Clements PJ, Davis J. Cytotoxic drugs: their clinical application to the rheumatic diseases. Sem Arth Rheum 1986;15:231—54.
- Kaye O, Palazzo E, Grossin M et al. Low-dose methotrexate: an effective corticosteroid-sparing agent in the musculoskeletal manifestations of sarcoidosis. Br J Rheumatol 1995;34:642—4.
- Lower EE, Baughman RP. Prolonged use of methotrexate for sarcoidosis. Arch Intern Med 1995;155:846—51.
- Bleyer WA. The clinical pharmacology of methotrexate: new applications of an old drug. Cancer 1978;41:36—51.
- Alarcon GS, Kremer JM, Macaluso M et al. Risk factors for methotrexate-induced lung injury in patients with rheumatoid arthritis. Ann Intern Med 1997;127:356—64
- Tortajada-Ituren JJ, Ordovas-Baines JP, Liopis-Salvia P, et al. High-dose methotexate-doxycycline interaction. Ann Pharmacother 1999;33:804-—8.
- Bernini JC, Fort DW, Griener JC et al. Aminophylline for methotrexate-induced neurotoxicity. Lancet 1995;345:544—7.
- Alarcon GS, Kremer JM, Macaluso M et al. Risk factors for methotrexate-induced lung injury in patients with rheumatoid arthritis. Ann Intern Med 1997;127:356—64.
- Cohen IJ, Stark B, Kaplinsky C, et al. methotrexate-induced leukoencephalopathy is treatable with high-dose folinic acid: a case report and analysis of the literature. Ped Hem Oncol 1990;7:79—87.
- Clinical Oncological
Society of Australia: Guidelines and recommendations for safe handling
of agents. Med J Australia 1983; 1:426-428.