MIASTENIA GRAVE [ICD-10: G70.0]
|
|
La miastenia grave es un desórden neuromuscular caracterizado por debilidad y fatiga de los músculos esqueléticos. El defecto subyacente es una disminución del número de receptores de acetilcolina en la unión neuromuscular. Descrita por primera vez por Thomas Willis en 1685 es una enfermedad relativamente frecuente, afectando a 1 persona de cada 7.500. La enfermedad puede producirse a cualquier edad, pero son más frecuentes los casos en las mujeres de 20 a 40 años y en los hombres de 50 a 70 años. Las mujeres son más afectadas que los hombres (3:2) |
|
|
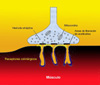
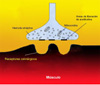
La acetilcolina es sintetizada en el área presináptica de la neuronas motoras y almacena en las vesículas sinápticas. Cuando un potencial de acción llega al terminal de una motoneurona, la acetilcolina de unas 150 a 200 vesículas es liberada en la hendidura sináptica alcanzando los receptores colinérgicos postsinápticos. Estos receptores han sido clonados y secuenciados, conociéndose perfectamente su estructura y función. En resumen, cuando la acetilcolina se une a su receptor, este se abre permitiendo la rápida entrada de cationes, sobre todo de sodio. Con ello se produce la despolarización de la región post-sináptica de la fibra muscular. Si la despolarización es bastante grande, se inicia un potencial de acción que se propaga por la fibra muscular produciendo la contracción muscular. En la miastenia grave, existe un defecto en el número de receptores disponibles de acetilcolina en la membrana muscular post-sináptica. Además, los pliegues de esta membrana están "aplanados" (*), todo lo cual resulta en una deficiente transmisión sináptica. De esta forma, aunque la acetilcolina se libera normalmente, no es capaz de ocasionar un potencial de acción en el músculo suficiente como para iniciar la contracción o debilitando esta. En los pacientes con miastenia grave, el fallo en activar los músculos es el responsable de la fatiga miasténica. |
Los defectos neuromusculares post-sinápticos observados en la miastenia grave son debidos a una respuesta autoinmune mediatizada por anticuerpos anti-receptores de acetilcolina (AChR). Estos anticuerpos pueden reducen el número de receptores AChR mediante varios mecanismos:
Aunque no sabe exactamente como se inicia la respuesta autoinmune, el timo parece estar involucrado de alguna manera. En el 75% de los pacientes con miastenia grave se observan anomalias (en el 65% de los casos se trata de hiperplasias, mientras que en el 10% se trata de timomas)
|
|
 |
Las características más importantes son fatiga y debilidad muscular. La distribución de la debilidad muscular es característica: los músculos más implicados son los craneales, en particular los párpados y los músculos extraoculares. Como resultado muchos pacientes muestran los párpados caídos (ptosis) y diplopía. Otros músculos implicados son los que la cara ocasionan un rictus cuando el paciente intenta sonreir y los músculos masticatorios y los que controlan la deglución y la palabra. Muchas veces lo pacientes tienen dificultades para deglutir y muestran una voz nasal. En el 85% de los casos se produce un debilidad muscular generalizada que suele ser proximal y puede ser asimétrica. Los reflejos tendinosos son normales. En algunos casos, la debilidad de los músculos respiratorios es tan acusada que el paciente puede requerir ventilación asistida. Se dice entonces que el sujeto atraviesa una crisis. |
|
Para el diagnóstico, se utiliza una serie de criterios (*) que deben ser confirmados ya que otras condiciones pueden presentar síntomas parecidos y el tratamiento de la miastenia grave puede implicar una intervención quirúrgica o la administración de fármacos con serias reacciones adversas. La sospecha de miastenia grave llega cuando se observan las manifestaciones antes señaladas de debilidad muscular sin pérdida de los reflejos. El diagnóstico debe ser confirmado mediante varias pruebas:
Los síndromes miasténicos congénitos constituyen en grupo heterogéneo de desórdenes no autoinmunes de la unión neuromuscular (*). Otras
condiciones que ocasionan debilidad muscular craneal o somática
son el miastenia inducida por fármacos, el síndrome
miasténico de Lambert-Eaton, la neurastenia, el botulismo,
el hipertiroidismo y los tumores craneales |
|
Gracias a los modernos tratamientos la mayor parte de los pacientes con miastenia grave pueden llevar una vida normal. Los tratamientos más útiles en esta enfermedad son los fármacos anticolinesterásicos, los inmunosupresores, la timectomía, las plasmaferesis y la inmunoglobulina Ig intravenosa Fármacos anticolinesterásicos: estos fármacos suelen aliviar los síntomas de los pacientes miasténicos aunque no en un 100%. No hay diferencias entre las diferentes medicaciones existentes (neostigmina, piridostigmina, etc) y estas deben emplearse sólas y no asociadas. La piridostigmina provoca con menor frecuencia dolores abdominales y diarrea y unos efectos terapeúticos más estables. Las dosis deben ajustarse en función de los resultados clínicos. En los casos de intensidad moderada puede iniciarse el tratamiento con 30 mg de neostigmina o 120 mg de piridostigmina 3 veces al día. Si no se observa mejoría, pueden acortarse los intervalos entre dosis o aumentar las dosis. Si la medicación es intramuscular, las dosis deben ser 10 veces menores y 30 veces si se elige la vía intravenosa Inmunosupresión: la inmunosupresión usando glucocorticoides, azatioprina u otros fármacos es efectiva en casi todos los pacientes con miastenia grave. La elección del fármaco dependerá de los riesgos y beneficios para cada paciente individual. Es interesante desarrollar pautas de tratamiento a corto, medio y largo plazo en función de los objetivos deseados. Por ejemplo, si el paciente necesita volver a su actividad, se considerará la plasmaferesis o la inmunoglobulina i.v. Para un tratamiento a medio plazo, la ciclosporina y los glucocorticoides proporcionan una mejoría en un plazo de 1 a 3 meses. Por el contrario, los beneficios de la azatioprina o del ácido micofenólico solo se aprecian después de muchos meses de tratamiento
Plasmaferesis: la plasmaferesis ha sido utilizada ocasionalmente para eliminar los anticuerpos patógenos del plasma de los pacientes con miastenia grave. Cuatro o cinco intercambios de plasma (de 3 a 4 litros por intercambio) en unas 2 semanas reducen significativamente la tasa de anticuerpos anti-AChRs mejorando clínicamente la mayor parte de los pacientes. Es un método útil para el alivio temporal de los síntomas de pacientes seriamente afectados o para mejorar la condición de paciente antes de una intervención quirúrgica Inmunoglobulina IgIV: las indicaciones para el empleo de la inmunoglobulina IgIV son las mismas que las de la plasmaferesis. La dosis usual es de 2 g/kg que se administran en el curso de 5 días (400 mg/kg/día). Si el fármaco es bien tolerado puede reducirse el curso de 3 días. Se observa una mejoría en la mayor parte de los pacientes a los 3-5 días, mejoría que se prolonga durante varios meses. No se conoce el mecanismo de acción de la IgIV Timectomia: Hay que distinguir entre la eliminación quirúrgica de un timoma (para evitar si diseminación aunque los timomas son en su mayor parte benignos) y la timectomia para el tratamiento de la miastenia grave. La evidencia sugiere que el 85% de los pacientes con miastenia grave mejorar después de una timectomía y que de estos, un 35% consiguen la completa remisión sin necesidad de medicación. Debido al bajo riesgo de esta intervención y sus beneficios potenciales, este procedimiento es considerado como el tratamiento de elección en todos los pacientes con miastenia grave generalizada entre la edad de la pubertad y los 55 años. La timectomía para el tratamiento de pacientes en los que la enfermedad se limita a una debilidad de los músculos oculares es objeto de debate |
|
REFERENCIAS
|
|
|
|
|
|
| Monografía revisada el 30 de Septiembre de 2005. Equipo de Redacción de IQB | |
|
|